La plateforme PRISMM propose l’analyse à haut débit de nucléosides modifiés par des agents génotoxiques endogènes ou exogènes. Plusieurs méthodes ont été proposées concernant le dosage en prestation ou en collaboration de :
- Douze adduits exocycliques (méthode validée1) provenant d’aldéhydes issus de la peroxydation lipidique tels que l’acroléine, le crotonaldéhyde, l’acétaldéhyde, le formaldéhyde, le malondialdéhyde, le 4-hydroxy-2-nonénal, le glyoxal et le méthylglyoxal.
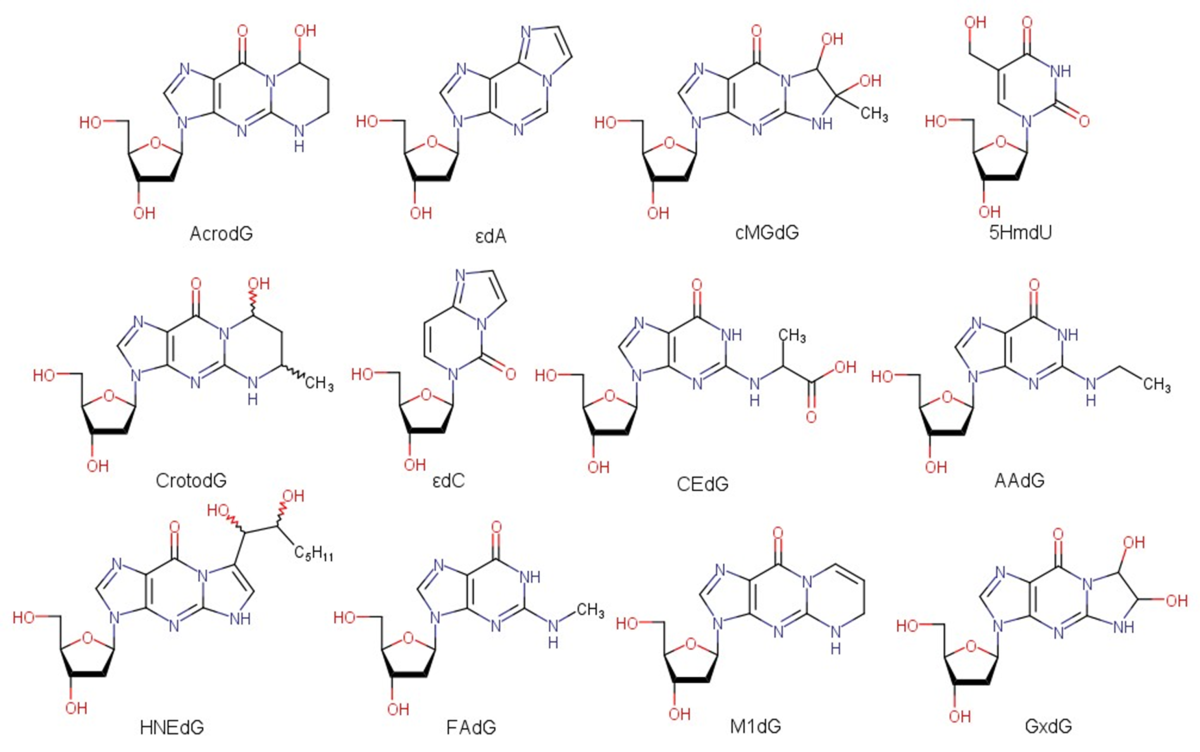
En complément, PRISMM propose le dosage en collaboration :
- Adduits aux HAP (benzo[a]pyrène)
- Adduits aux oxy-HAP (1,2-naphtoquinone2, 7,12-benzo[a]anthracenequinone, 6H-benzo[cd]pyren-6-one)
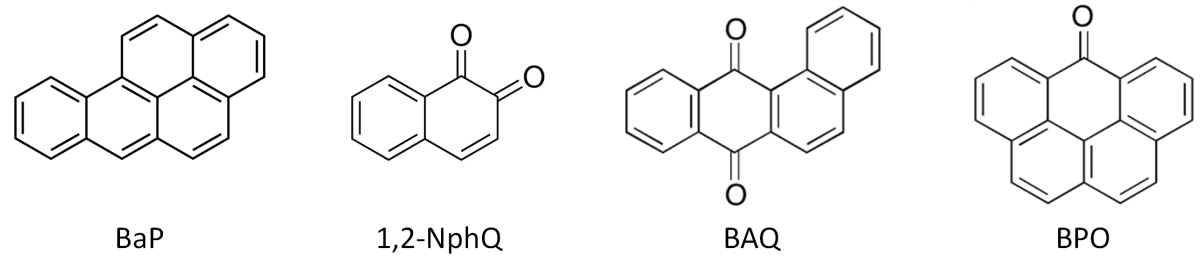
Ces méthodes permettent de réaliser le dosage simultané des marqueurs épigénétiques.
Le concept de l’exposome regroupe de nombreux composé dont peu ont fait l’objet d’une évaluation approfondie quant à leur dangerosité. Parmi ces composés, les hydrocarbures polycycliques aromatiques (HAP), les HAP oxygénés (oxy-HAP) et les aldéhydes sont présents dans la plupart des environnements. L’homme y est donc exposé de manière chronique. D’autre part, les aldéhydes peuvent être produits de manière endogène par le stress oxydant et sont connus pour déclencher des réponses cellulaires mutagènes et initier la cancérogenèse. Il est donc important des pouvoir doser l’exposition à ces composés. De nombreuses études dans la seconde moitié du 20ème siècle ont mis en évidence que des génotoxiques cancérogènes réagissaient, soit directement, soit par activation métabolique, avec l’ADN pour former des adduits par liaison covalente. La technique la plus couramment utilisée dans le cadre de l’étude des adduits à l’ADN est celle du marquage au phosphore 32 3. Elle ne permet cependant pas l’identification des composés qui sont analysés.

1-Alamil H., Lechevrel M., Lagadu S., Galanti L., Dagher Z., Delépée R. A validated UHPLC-MS/MS method for simultaneous quantification of 9 exocyclic DNA adducts induced by 8 aldehydes. Journal of Pharmaceutical and Biomedical Analysis. 2020, 179 pp.113007. DOI: 10.1016/j.jpba.2019.113007
2 – Clergé A, Le Goff J, Lopez-Piffet C, Meier S, Lagadu S, Vaudorne I, Babin V, Cailly T, Delépée R. Investigation by mass spectrometry and 32P post-labelling of DNA adducts formation from 1,2-naphthoquinone, an oxydated metabolite of naphthalene. Chemosphere. 2021 Jan;263:128079. doi: 10.1016/j.chemosphere.2020.128079. Epub 2020 Aug 31. PMID: 33297078.
3 – Le Goff J., Andre V., Lebailly P., Pottier D., Périn F., Périn O., Gauduchon P., Seasonal variations of DNA-adduct patterns in open field farmers handling pesticides. 587(1-2):90-102. DOI:10.1016/j.mrgentox.2005.05.013

